Thermodinamika
adalah ilmu tentang energi, yang secara spesific membahas tentang hubungan
antara energi panas dengan kerja. Seperti telah diketahui bahwa energi didalam
alam dapat terwujud dalam berbagai bentuk, selain energi panas dan kerja, yaitu
energi kimia, energi listrik, energi nuklir, energi gelombang elektromagnit,
energi akibat gaya magnit, dan lain-lain . Energi dapat berubah dari satu
bentuk ke bentuk lain, baik secara alami maupun hasil rekayasa tehnologi.
Selain itu energi di alam semesta bersifat kekal, tidak dapat dibangkitkan atau
dihilangkan, yang terjadi adalah perubahan energi dari satu bentuk menjadi
bentuk lain tanpa ada pengurangan atau penambahan. Prinsip ini disebut sebagai
prinsip konservasi atau kekekalan energi.
Prinsip
thermodinamika tersebut sebenarnya telah terjadi secara alami dalam kehidupan
sehari-hari. Bumi setiap hari menerima energi gelombang elektromagnetik dari
matahari, dan dibumi energi tersebut berubah menjadi energi panas, energi
angin, gelombang laut, proses pertumbuhan berbagai tumbuh-tumbuhan dan banyak
proses alam lainnya. Proses didalam diri manusia juga merupakan proses konversi
energi yang kompleks, dari input energi kimia dalam maka nan menjadi energi
gerak berupa segala kegiatan fisik manusia, dan energi yang sangat bernilai
yaitu energi pikiran kita.
Dengan berkembangnya ilmu pengetahuan dan
teknologi, maka prinsip alamiah dalam berbagai proses thermodinamika direkayasa
menjadi berbagai bentuk mekanisme untuk membantu manusia dalam menjalankan
kegiatannya. Mesin-mesin transportasi darat, laut, maupun udara merupakan
contoh yang sangat kita kenal dari mesin konversi energi, yang merubah energi
kimia dalam bahan bakar atau sumber energi lain menjadi energi mekanis dalam bentuk
gerak atau perpindahan diatas permukaan bumi, bahkan sampai di luar angkasa.
Pabrik-pabrik dapat memproduksi berbagai jenis barang, digerakkan oleh mesin
pembangkit energi listrik yang menggunakan prinsip
konversi energi panas dan kerja. Untuk kenyamanan hidup, kita memanfaatkan
mesin air conditioning, mesin pemanas, dan refrigerators yang
menggunakan prinsip dasar thermodinamila.
Sistem termodinamika adalah sejumlah tertentu
dari materi yang terkandung dalam suatu permukaan tertutup. Permukaan tersebut
biasanya sangat mudah dikenali seperti misalnya silinder yang menyimpan gas
pada gambar 1.1. Akan tetapi dapat pula berupa suatu pembataas imajiner seperti
batas berubah bentuk yang mengelilingi sejumlah massa tertentu yang mengalir
melalui suatu pompa. Pada gambar 1.1, yang dimaksud dengan sistem adalah gas
bertekanan, fluida kerjadnya, sedangkan yang menjadi batas sistemnya
ditunjukkan oleh garis putus-putus.
Semua
materi dan ruang yang berada di luar suatu sistem kolektif disebut sebagi
lingkungan (surrounding) dari sistem
tersebut. termodinamika berurusan dengan interaksi antara suatu sistem dengan
lingkungannya, atau antara suatu sistem dengan sistem lainnya. Suatu sistem
berinteraksi dengan lingkungannya melalui transfer energi melewati pembatasnya.
Tidak ada materi yang melintasi pembatas dari suatu sistem. Jika sistem
tersebut tidak bertukar enegeri dengan lingkungannya, sistem tersebut disebut
sistem terisolasi.
Dalam
banyak kasus, analisis disederhanakan jika focus perhatiannya adalah suatu
volume dalam ruang ke mana, atau dari mana, suatu zat (substance) mengalir. Suatu volume demikian disebut volume kontrol (control volume). Pompa, turbin, balon
pemompa (inflating balloon), adalah
contoh-contoh
dari volume kontrol. Permukaan yang secara penuh mengelilingi volume kontrol
disebut suatu permukaan kontrol (control
surface).
JENIS-JENIS SISTEM TERMODINAMIKA
Ada tiga jenis sistem berdasarkan jenis
pertukaran yang terjadi antara sistem dan lingkungan:
1. Sistem
terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan lingkungan.
Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas
terisolasi.
Sistem yang tidak mengakibatkan
terjadinya pertukaran panas, zat atau kerja dengan lingkungannya. Contohnya :
air yang disimpan dalam termos. Dalam kenyataan, sebuah sistem tidak dapat
terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit
pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam
analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang
keluar dari sistem.
Termos
Pada alat rumah tangga tersebut terdapat aplikasi hukum I termodinamika dengan
sistem terisolasi. Dimana tabung bagian dalam termos yang digunakan sebagai
wadah air, terisolasi dari lingkungan luar karena adanya ruang hampa udara di
antara tabung bagian dalam dan luar. Maka dari itu, pada
termos tidak terjadi perpindahan kalor maupun benda dari sistem menuju
lingkungan maupun sebaliknya.2. Mesin kendaraan bermotor Pada mesin kendaraan
bermotor terdapat aplikasi termodinamika dengan sistem terbuka. Dimana ruang
didalam silinder mesin merupakan sistem, kemudian campuran bahan bakar dan
udara masuk ke dalam silinder, dan gas buang keluar sistem melalui knalpot.
1.
Sistem tertutup: terjadi pertukaran energi
(panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau
adalah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi
tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi
pertukaran panas, kerja atau keduanya biasanya dipertimbangkanh sebagai sifat
pembatasnya:
Ø pembatas
adiabatik: tidak memperbolehkan pertukaran panas.
Ø pembatas
rigid: tidak memperbolehkan pertukaran kerja.
Pada Sistem tertutup terjadi pertukaran energi (panas dan kerja)
tetapi tidak terjadi pertukaran benda dengan lingkungan. Dalam sistem tertutup
masa dari sistem yang dianalisis tetap dan tidak ada masa keluar dari sistem
atau masuk kedalam sistem, tetapi volumenya bisa berubah. Yang dapat keluar
masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Contoh sistem tertutup
adalah suatu balon udara yang dipanaskan, dimana masa udara didalam balon
tetap, tetapi volumenya berubah, dan energi panas masuk kedalam masa udara
didalam balon. Selain itu Rumah hijau adalah contoh dari sistem tertutup di
mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja.
2.
Sistem terbuka: terjadi pertukaran energi
(panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra
merupakan contoh dari sistem terbuka.
Dalam kenyataan, sebuah sistem tidak
dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pecampuran,
meskipun hanya penerimaan sedikit penarikan gravitasi.
Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan
energi yang keluar dari sistem.
Sistem
terbuka yaitu terjadi pertukaran energi (panas dan kerja) dan benda dengan
lingkungannya. Dalam sistem terbuka, energi dan masa dapat keluar sistem atau
masuk kedalam sistem melewati batas sistem. Sebagian besar mesinmesin konversi
energi adalah sistem terbuka. Sistem mesin motor bakar adalah ruang didalam
silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam
silinder, dan gas buang keluar sistemmelalui knalpot. Turbin gas, turbin uap,
pesawat jet dan lain-lain adalah merupakan sistem thermodinamika terbuka,
karena secara simultan ada energi dan masa keluar-masuk sistem tersebut.
Persamaan keadaan adalah persamaan termodinamika
yang menggambarkan keadaan materi di bawah seperangkat kondisi fisika.
Persamaan keadaan adalah sebuah persamaan konstitutif yang menyediakan hubungan matematik antara dua
atau lebih fungsi keadaan yang
berhubungan dengan materi, seperti temperatur, tekanan, volume dan energi dalam. Persamaan keadaan berguna dalam menggambarkan
sifat-sifat fluida,
campuran fluida, padatan, dan
bahkan bagian dalam bintang. Penggunaan
paling umum dari sebuah persamaan keadaan adalah dalam memprediksi keadaan gas
dan cairan. Salah satu persamaan keadaan paling sederhana dalam penggunaan ini
adalah hukum gas ideal, yang cukup akurat dalam memprediksi keadaan gas
pada tekanan rendah dan temperatur tinggi. Tetapi persamaan ini menjadi semakin
tidak akurat pada tekanan yang makin tinggi dan temperatur yang makin rendah,
dan gagal dalam memprediksi kondensasi dari gas menjadi cairan. Namun demikian,
sejumlah persamaan keadaan yang lebih akurat telah dikembangkan untuk berbagai
macam gas dan cairan. Saat ini, tidak ada persamaan keadaan tunggal yang dapat
dengan akurat memperkirakan sifat-sifat semua zat pada semua kondisi.
Ketika sistem dalam keadaan seimbang dalam kondisi yang ditentukan, ini
disebut dalam keadaan pasti (atau keadaan sistem). Untuk keadaan termodinamika tertentu, banyak
sifat dari sistem dispesifikasikan. Properti yang tidak tergantung dengan jalur
di mana sistem itu membentuk keadaan tersebut, disebut fungsi keadaan dari
sistem. Bagian selanjutnya dalam seksi ini hanya mempertimbangkan properti,
yang merupakan fungsi keadaan. Jumlah
properti minimal yang harus dispesifikasikan untuk menjelaskan keadaan dari
sistem tertentu ditentukan oleh Hukum fase Gibbs.
Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari
jumlah minimal tersebut. Pengembangan
hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan
keadaan adalah contoh dari hubungan tersebut.
Ø Keadaan seimbang mekanis : Sistem berada
dalam keadaan seimbang mekanis, apabila resultan semua gaya (luar maupun dalam)
adalah nol
Ø Keadaan seimbang kimiawi : Sistem berada
dalam keadaan seimbang kimiawi, apabila didalamnya tidak terjadi perpindahan
zat dari bagian yang satu ke bagian yang lain (difusi) dan tidak terjadi
reaksi-reaksi kimiawi yang dapat mengubah jumlah partikel semulanya ; tidak
terjadi pelarutan atau kondensasi. Sistem itu tetap komposisi maupun konsentrasnya.
Keadaan seimbang termal : sistem berada dalam
keadaan seimabng termal dengna lingkungannya, apbiala koordinat-kooridnatnya
tidak berubah, meskipun sistem berkontak dengan ingkungannnya melalui dinding
diatermik. Besar/nilai koordinat sisterm tidak berubah dengan Ø perubahan waktu.
Ø Keadaan keseimbang termodinamika : sistem
berada dalam keadaan seimbang termodinamika, apabila ketiga syarat keseimbangan
diatas terpenuhi. Dalam keadan demikian keadaan keadaan koordinat sistem maupun
lingkungan cenderung tidak berubah sepanjang massa. Termodinamika hanya
mempelajari sistem-sistem dalam keadaan demikian.
Dalam keadan seimbang
termodinamis, hanya dua diantara ketiga koordinat sistem merupakan variabel
bebas.
Contoh : Sistem = penjumlahan gas dalam bejana.
Perhatikan tiga koorinatnya P, V dan T (dari jumlah 8 yang ada). Kalau V dan T
ditentukan terlebih dahulu secara bebas (misal gas dimasukkan dalam bejana
tertentu, dan dipanasi sampai suhu tertentu), maka tekannya sudah memiliki
nilai tertentu tidak dapat dapat kita tentukan secara bebas. Berlaku :
f(P,V,T)=0 disebut persamaan keadaan gas.
Beberapa sistem termodinamika (Jumlah partikel tetap) :
o Sistem hidrostatik
Sistem hidrostatik = gas, cairan, padatan (atau campurannya) suatu zat
kimiawi, tanpa memperhatikan sifat listrik dan sifat magnetiknya.
Disebut zat murni, apabila terdiri atas 1 senyawa kimiawi saja,misal H2O
Disebut zat tak murni, apabila terdiri atas campuran atas beberapa zat murni, misalnya O2 dan N2.
Persamaan keaadaanya : f(P,V,T)=0 misalnya PV=nRT, disebut persamaan gas ideal.
Sistem paramagnetik = gas, cairan, padatan (atau campurannya) dari zat
yang bersifat paramagnetik, seperti Al, Ca, Cr, Mg dll. Atom-atom ini memiliki momen (atau dipol)
magnetik (atau Pm) tertentu dan karenanya merupakan magnet kecil disebut
magnet elementer. Momen magnet ini bersumber pada elektron yang mengelilingi
inti dalam kulit (atau subkulit) yang tidak penuh seluruhnya. Momen magnet atom dinyatakan dalam satuan
(nol) SI yang disebut magneton Bohr . Pertama-tama sistem paramagnetik mamiliki suatu koordinat
yakni besaran-besaran yang menyatakan kuat medan magnet luar, disebut induksi
magnet B
Apabila zat
dielektrik dimasukkan dalam medan magnet έ , terjadilah polarisasi atom (atau
molekkul) didalamnya, yakni karena imbas medan listrik luar itu, pusat muatan
positif inti dan elektron atom tidak lagi berimpit, melainkan agak tegeser, hingga atom (molekul)
menyerupai dipol listrik kecil.
Benda
dielektrik secara kesluruhan memiliki apa yang disebut polarisasi P , yang
secara termodinamis merupakan salsah satu koordinat sistem dielektrik.
Koordinat yang lain tentunya medan listrik , karena mereka saling
mempengaruhi
Dawai yang diberi tegangan juga dapat dilihat
sebagai suatu sistem termodnamika.
o
Selaput
tipis (thin layer), misalnya
minyak diatas air
o
Sel listrik
(aki)

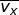 ), sumbu-y (
), sumbu-y ( 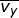 ), dan sumbu-z (
), dan sumbu-z ( 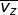 ), yang besarnya sama. Oleh karena itu, dapat dituliskan
), yang besarnya sama. Oleh karena itu, dapat dituliskan 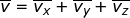 dengan
dengan 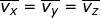 . Jika setiap komponen pada kedua ruas penamaan kecepatan tersebut dikuadratkan, dapat dituliskan :
. Jika setiap komponen pada kedua ruas penamaan kecepatan tersebut dikuadratkan, dapat dituliskan :











